Skrivet av Per Stolt • 14 december, 2022 04:05
Intervjun:
Paul de Potocki (VD) OncoZenge

Paul de Potocki (VD) OncoZenge
Detta är en intervju i ett betalt samarbete
OncoZenges aktie har haft ett turbulent år 2022. Bolaget har pausat fas 3 studie i väntan på omformulering av sitt läkemedel BupiZenge. Vi är nyfikna på hur långt man kommit i utvecklingen och hur bolaget ser på vägen framåt. Vi tror att 2023 kan bli intressant år för OncoZenge och valt att intervjua VD Paul de Potocki.
1: Berätta om OncoZenge, och vilka kandidater ni för tillfället utvecklar!
Paul de Potocki (VD) OncoZenge: OncoZenge är ett svenskt läkemedelsbolag som utvecklar ett nytt läkemedel, BupiZenge, för lokal smärtlindring i mun och svalg. Den första indikationen är smärta orsakad av oral mukosit.”
2: Berätta lite om dig själv och din egen bakgrund!
Paul de Potocki (VD) OncoZenge: Jag har varit verksam inom Life Science sedan 1995 och har främst arbetat med försäljning, affärsutveckling och företagsledning inom läkemedel, bioteknik och medicinsk teknik. Vid sidan av OncoZenge arbetar jag idag även i styrelsen för Palette Life Sciences och Asarina AB.
3: Ni har fokus på att utveckla BupiZenge i indikationen Oral Mucositis. Vad är Oral Mucositis, och vad är substansens relevans i den indikationen?
Paul de Potocki (VD) OncoZenge: Oral mukosit är en omfattande och allvarlig biverkan av kemo- och strålterapi vid behandling av cancer. Dessa cancerbehandlingar, som syftar till att döda cancerceller, påverkar ofta även friska vävnader såsom våra slemhinnor och kan orsaka inflammation och smärtsamma sår i mun och svalg under flera veckors tid.
Detta medför betydande inverkan på patienters livskvalitet; svår smärta, svårigheter att äta, dricka och svälja, och kan även orsaka avbrott i cancerbehandlingen. Det finns idag ingen förebyggande eller botande behandling av oral mukosit, och heller inget godkänt läkemedel för lokal behandling av smärtan som orsakas av inflammation och sår i mun och svalg.
BupiZenge är en ny formulering av ett välbeprövat smärtlindrande preparat, bupivakain, i form av en sugtablett. Produkten möter ett stort patientbehov av lokal smärtlindring för att minska lidande, undvika kostsam sjukhusvård och hjälpa patienter genom sin cancerbehandling med ett minskat eller eliminerat behov av systemisk smärtbehandling med opioidpreparat.
4: BupiZenge har testats i fas 1 och fas 2 studier med uppnådda mål. Vad sa dessa studier om preparatets förmåga om ”smärtlindring”?
Paul de Potocki (VD) OncoZenge: I genomförda fas I- och fas II-studier har bupivakain sugtabletten visat god säkerhet utan allvarliga biverkningar. Resultaten från fas II-studien visar med hög signifikans en god smärtstillande effekt som är väsentligt bättre än tillgänglig standardbehandling.
5: Inför kommande fas 3 håller ni just nu på att omformulera BupiZenge, efter feedback från FDA tidigare i vår. Vad var skälen att ni valde omformulera BupiZenge?
Paul de Potocki (VD) OncoZenge: ”Bupivakain har en bitter smak och för att täcka denna formulerades BupiZenge ursprungligen med lakrits som smaktäckning.
Den amerikanska myndigheten FDA har dock som krav att samtliga ingående komponenter i ett läkemedel ska vara testade och godkända, även om dessa används inom livsmedelsindustrin. Lakrits innehåller en farmakologiskt aktiv substans som vid stora mängder under längre användning kan orsaka förhöjt blodtryck.
FDA krävde därför att separata toxikologiska studier måste utföras specifikt för lakritskomponenten innan längre patientstudier med BupiZenge får initieras. Detta var inte ett krav vid OncoZenges tidigare kontakter med europeiska myndigheter.
Eftersom den amerikanska marknaden är stor och viktig, har bolaget gjort bedömningen att den bästa vägen framåt är att göra en omformulering och byta smaktäckning på sugtabletten.
6: Har FDA haft några invändningar mot bupivakain i samband med att man krävde in mer studier angående lakrits-smaksättaren?
Paul de Potocki (VD) OncoZenge: Bupivakain är ett väldokumenterat lokalanestesimedel som ingår i flera FDA-godkända produkter och de regulatoriska myndigheterna har inga generella invändningar mot preparatet.
Däremot måste vi, liksom alla bolag som utvecklar nya läkemedel, påvisa att vår produkt i dess slutliga formulering och avsedda dosering, behandlingstid och patientpopulation är säker att använda.
OncoZenge har genomfört en toxikologisk studie med bupivakain som visar god säkerhetsmarginal för planerad dosering av BupiZenge vid kontinuerlig behandling över sex veckor och vi planerar nu i dialog med regulatoriska myndigheter i USA och Europa det slutgiltiga kliniska programmet för BupiZenge.
7: Kan du beskriva vilka steg som ingår i omformuleringen av BupiZenge, innan ny fas 3 ansökan till FDA blir aktuell och hur ser tidslinjen ut för den processen?
Paul de Potocki (VD) OncoZenge: En omformulering av en läkemedelskandidat kan framstå som en relativt enkel och snabb process. Arbetet är dock förknippat med en hel del tidskrävande och regelstyrda steg.
En ny smaksättning av BupiZenge måste vara acceptabel hos patienter som i vissa fall har en förvrängd smakupplevelse till följd av deras sjukdom. Den nya formuleringen skall vara optimerad för storskalig kommersiell produktion och kunna analyseras för renhet.
Samtliga ingående komponenter skall vara godkända för bruk i läkemedel utan krav på tillkommande specifika säkerhetsstudier. Inför en klinisk patientstudie ska tabletter med den finala formuleringen också produceras i enlighet med GMP och därefter måste tillräckliga stabilitetsdata för slutprodukten genereras innan patientstudier kan starta.
Detta innebär sammantaget att en farmakokinetisk (PK) patientstudie med den nya formuleringen planeras kunna starta under den andra halvan av 2023.
Denna studie bedöms vara det sista steget innan pivotala fas III-studier för USA och Europa kan inledas. PK-studien kommer att omfatta ett begränsat antal patienter i Europa för behandling och provtagningar under ett dygn och uppföljning några dagar senare.
Kinetik- och effektdata kommer att inhämtas för två olika tablettstyrkor och från patienter med olika svårighetsgrader av oral mukosit. I samband med denna studie avser vi även ansöka om tillkommande patent för BupiZenge.
8: Vad vi förstår kommer ni inte att driva fas 3 i egen regi. Hur ser affärsplanen ut inför fas 3? Kommer ni leta partners eller är hela bolaget till salu? Och när i processen kommer detta ske?
Paul de Potocki (VD) OncoZenge: Lansering av nya läkemedel för en bred patientpopulation på en internationell marknad kräver stora resurser och en befintlig kommersiell organisation.
Det är därför vanligt att mindre bioteknik- och läkemedelsbolag ingår kommersiella partnerskap, licensierings- eller försäljningsavtal med större läkemedelsbolag vid något skede innan kommersialisering.
Det bolag som i slutändan ska sälja det nya läkemedlet vill gärna engagera sig i samband med fas III-studier för att kunna påverka studieprotokoll, interagera med regulatoriska myndigheter, samt förbereda storskalig produktion, logistik och prelanseringsaktiviteter.
En läkemedelskandidat som är ’fas III-redo’ är en attraktiv tillgång för många större farmabolag, och detta utvecklingsstadiet utgör generellt den optimala tidpunkten avseende värdeskapande för det mindre bolaget.
OncoZenge kommer i samband med starten av den farmakokinetiska patientstudien att inleda en formell process för att hitta en utvecklingspartner, licenstagare eller köpare.
9: Det finns flera studier som även visar att bupivakain hjälpt minska tumörprogression, är detta något som kan vara intressant att utveckla?
Bupivakain som substans och BupiZenge som produkt har flera potentiella användningsområden relaterade till både smärttillstånd i mun och svalg och andra indikationer. OncoZenge är idag fokuserade på att som första steg utveckla BupiZenge för behandling av smärta i samband med oral mukosit hos cancerpatienter.
10: Finns det konkurrerande preparat eller studier, och hur skiljer sig BupiZenge från dem?
Paul de Potocki (VD) OncoZenge: OncoZenge är idag, vad vi vet, det enda bolaget i världen som utvecklar ett nytt läkemedel för behandling av lokal oral smärta hos cancerpatienter.
11: Bupivakain används för att skapa långvarig lokalanestesi (lokalbedövnig), Om substansens fungerar i Oral Mucositis, finns det då anledning att tro BupiZenge kan vara effektiv vid smärtlindring mot andra indikationer i munhålan?
Paul de Potocki (VD) OncoZenge: Det är ett rimligt antagande att BupiZenge kan vara effektivt vid till exempel Burning Mouth Syndrome, samt för smärtlindring vid ingrepp i mun och svalg och endoskopiska undersökningar.
12: Ur ett investerarperspektiv, varför skall man investera i OncoZenge?
Paul de Potocki (VD) OncoZenge: Generellt för bioteknik- och läkemedels-utvecklingsbolag anser jag att det finns några fundamentala parametrar att överväga:
- Adresserar produkten ett stort och idag otillfredsställt patientbehov
- Är produkten unik och fri från känd konkurrens
- Finns patentskydd för viktiga marknader
- Finns det en tydlig regulatorisk väg till myndighetsgodkännanden i USA och Europa, och
- Har bolaget god vetenskaplig och kommersiell kompetens?
Läkemedelsutveckling är en riskfylld verksamhet som vid framgång kan generera stora värden. Den kliniska risken vid utveckling av en ny produkt baserad på en känd och väldokumenterad aktiv substans är dock rimligen lägre jämfört med utveckling av helt nya och obeprövade substanser.
OncoZenges produktkandidat kan dessutom minska dagens användning av opioider, vilket är en uttalad målsättning hos hälsomyndigheter både i USA och i Europa.
Jag är mycket hoppfull att OncoZenge kommer att kunna utveckla både ett viktigt nytt läkemedel och ett värdefullt bolag!
Dagens Börs tackar Paul de Potocki (VD) OncoZenge för en mycket intressant intervju och vi önskar honom och OncoZenge lycka framöver!
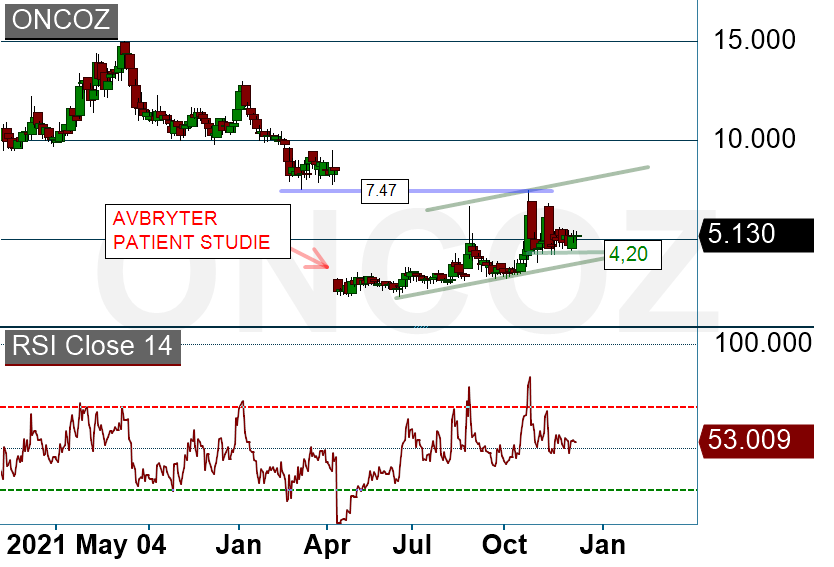
Diagram ovan: OncoZenge (diagram källa: infront)



